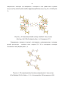Содержание к диссертации
Введение
ГЛАВА 1. Дизайн, структура и свойства координационных полимеров на базе ферроценсодержащих кислот 8
1.1. Координационные полимеры на основе ферроценсодержащих карбоновых кислот. Дизайн, структура и свойства 9
1.2. Ферроценкарбоновые кислоты со спейсером между ферроценом и карбоксилатной группой 15
1.3. Другие ферроценсодержащие кислоты 21
ГЛАВА 2. Синтез, структура и координационные свойства ферроценилфосфиновых кислот 30
2.1. Способ получения ферроценилфосфиновых кислот 31
2.2. Кристаллическая структура и упаковка ферроценилфосфиновых кислот 35
2.3. Электрохимические свойства ферроценилфосфиновых кислот 45
2.4. Комплексообразующие свойства ферроценилфосфиновых кислот 50
2.5. Комплексообразующие свойства 1,Г-ферроцендиил-бис(фосфиновых кислот) 56
2.6. Разработка методов синтеза трехмерных координационных полимеров на основе 1,Г-ферроцендиил-бис(фосфиновыхкислот) 68
2.7. Магнитные свойства координационных полимеров на основе ферроценилфосфиновых кислот 79
ГЛАВА 3. Экспериментальная часть 87
3.1. Синтез ферроценилфосфиновых кислот 89
3.2. Синтез 1,Г-ферроцендиил-бис(фосфиновыхкислот) 93
3.3. Получение солей аммония 1,Г-ферроцендиил-бис(фосфиновых кислот) 98
3.4. Синтез комплексов 1,Г-ферроцендиил-бис(фенилфосфиновойкислоты) 99
3.5. Синтез координационных полимеров 99
Выводы 119
Список сокращений 121
Список использованной литературы
- Ферроценкарбоновые кислоты со спейсером между ферроценом и карбоксилатной группой
- Другие ферроценсодержащие кислоты
- Кристаллическая структура и упаковка ферроценилфосфиновых кислот
- Получение солей аммония 1,Г-ферроцендиил-бис(фосфиновых кислот)
Ферроценкарбоновые кислоты со спейсером между ферроценом и карбоксилатной группой
К настоящему времени синтезировано значительное количество ферроценкарбоновых кислот (11-19), содержащих спейсер между ферроценовым и карбоксилатным фрагментами (Рисунок 9), что позволило уменьшить стерическое влияние объемных ферроценовых групп и существенно увеличить лабильность лигандов (11-19). При этом наблюдается уменьшение роли ферроценового фрагмента и значительное увеличение влияния дополнительных нейтральных N-донорных лигандов на образование главной цепи координационного полимера. о-СООН (16а) м-СООН (16Ь) п-СООН (16с)
Так, нитраты Cd(II) или Zn(II) вступают во взаимодействие с кислотой 11 с образованием дискретных комплексов, которые могут выступать в роли вторичных строительных блоков, вступая во взаимодействие с различными N-донорными лигандами. При этом строение координационного соединения существенным образом определяется природой N-донорного лиганда, приводя к образованию одномерного координационного полимера 20 в случае bbbm или дискретного комплекса 21 в случае ntb (ntb = К,К-бис(Ш-бензимидазол-2-илметил)-Ш- бензимидазол -2-метанамин) [57].
Значительное влияние дополнительных N-донорных лигандов на строение координационного полимера было показано и на примере реакций комплексообразования кислоты 13 с переходными металлами. Так, в отсутствии дополнительного N-донорного лиганда кислота 13 образует с производными Zn(II) одномерный координационный полимер 22, цепь которого состоит из мостиковых ферроценкарбоксилатных лигандов и катионов Zn(II) с тетраэдрическим окружением. Соединение 22 способствует стабилизации наночастиц ZnS [58], что является перспективным методом создания функциональных наноматериалов.
Вместе с тем, использование дополнительного нейтрального лиганда 1,2-бис(4-пиридил)этана приводит к образованию одномерного координационного полимера 23 совершенного другого типа строения [59], в котором состоящие из двух атомов Zn(II) и четырех карбоксилатных анионов 13 вторичные строительные блоки типа paddle-wheel связаны в цепь посредством N-донорного лиганда (Рисунок 10).
Стоит отметить, что электрохимические свойства координационных полимеров 23 практически не отличаются от соответствующих значений свободных лигандов 13, что свидетельствует об отсутствии значительного перераспределения электронной плотности в структуре полимера.
Вместе с тем, существенное изменение потенциала окисления наблюдается для координационных полимеров на основе кислот 13-14 [60]. Образование одномерных полимеров 24 приводит к сдвигу потенциала полуволны окисления в область более высоких значений приблизительно на 0.1В. Однако более подробное изучение электрохимического поведения координационного полимера 25 состава [Zn(14)2 pbbm] (pbbm = 1,Г-(1,5-пентаметилен)бис-Ш-бензимидазол), в котором также наблюдается изменение потенциала окисления на 0.1 В по сравнению со свободной кислотой 14, показало отсутствие каких-либо электронных взаимодействий между ферроценовыми фрагментами [61] (Рисунок 11). Рисунок 11. Строение координационного полимера 25 [61]
Аналогичное изменение потенциала окисления координационных полимеров по сравнению со свободными лигандами наблюдается и в случае одномерных полимеров лестничного типа состава [Мг(15)4Ьіру2 МеОН] 26, в которых ион металла (М(П) = Zn или Cd) имеет необычную координацию тригональной бипирамиды [62].
Более значительный сдвиг потенциала окисления в более высокие значения наблюдается для координационных полимеров на основе ферроценсодержащих карбоновых кислот 16-17, в которых роль спейсера между ферроценом и карбоксилатной группой выполняет ариленовый фрагмент, что, вероятно, обусловлено наличием сопряжения я-систем ферроцена, бензольного кольца и карбоксилатной группы и существенного перераспределения электронной плотности внутри полимера. Дополнительным подтверждением данного факта является существенное увеличение констант обменных антиферромагнитных взаимодействий координационных полимеров на основе марганца (II) и кислоты 16 по сравнению со схожими производными аренфосфиновых кислот [63].
Аналогичное поведение демонстрируют и координационные полимеры на основе 2-хлор-4-ферроценилбензойной кислоты (16а) [64]. Так показано, что в зависимости от условий проведения процесса могут быть получены как моноядерный комплекс 27 состава [Pb(16a)2phen MeOH H20] (phen = 1,10-фенантролин), так и ID координационный полимер 28 состава [Pb(16a)2phen]n, в которых имеет место реализация хелатирующего или мостикового типа связывания соответственно (Рисунок 12). Рисунок 12. Строение координационного полимера 28 [64]
Образование одномерных координационных полимеров схожего строения было зафиксировано и в ходе реакций л/-ферроценилбензойной (16Ь) и п-ферроценилбензойной (16с) кислот с производными лантанидов [65, 66]. Так, применение метода слоистой диффузии водно-метанольных растворов солей Ln(III) и натриевой соли кислоты 16 приводит к образованию изоструктурной серии одномерных координационных полимеров с различными типами связывания лиганда. При этом установлено, что магнитные свойства образующихся полимеров существенным образом зависят от типа используемого металла и кислоты: наибольшую амплитуду обменных взаимодействий демонстрируют производные гадолиния. Но для полимера на основе лиганда 16Ь наблюдается антиферромагнитные обменные взаимодействия, в то время как в случае полимера кислоты 16с - ферромагнитные. По мнению авторов, подобное различие обусловлено различным типом координации лигандов [65, 66].
Введение второй карбоксилатной группы в ферроценовый фрагмент кислоты 17 не приводит к существенному изменению топологии образующихся полимеров на основе d-металлов. В зависимости от вида дополнительного нейтрального N-донорного лиганда были получены полимеры линейного или спирального типа [67], в которых имеются слабые антиферромагнитные обменные взаимодействия, схожие со свойствами ферроценсодержащих координационных полимеров на базе лантанидов и кислоты 18 [68]. Следует отметить и еще одну потенциальную область применения координационных полимеров на основе ферроценсодержащих карбоновых кислот и лантанидов - люминесценцию. Так одномерные координационные полимеры на основе кислоты 18 и церия демонстрируют необычно высокие значения интенсивности эмиссии света с максимумом ХШах = 398 нм. Более того, использование 1,Г-дизамещенной кислоты 19 в смеси с 4,4 -триметилен-дипиридином позволило синтезировать двумерный координационный полимер на базе Cd(II), проявляющий нелинейно-оптические свойства третьего порядка [69].
Относительно новым, но перспективным направлением химии ферроценсодержащих комплексов и координационных полимеров является изучение хиральных кислот, которые в настоящее время представлены лишь несколькими примерами. [70, 71, 72, 73].
Вышеописанные ферроценкарбоновые кислоты являются самым большим и наиболее изученным классом ферроценсодержащих кислот. Другие кислоты, содержащие ферроценовый фрагмент, представлены значительно меньшим числом.
Так, ферроценилборные кислоты в основном используются в качестве прекурсоров при создании ферроценилсодержащих соединений с использованием реакций кросс-сочетания Сузуки [74, 75]. Комплексообразующие свойства ферроценилборных кислот до настоящего времени остаются неизученными. Ферроценилсодержащие диолы кремния изучены немного лучше [76, 77].
Другие ферроценсодержащие кислоты
Следует отметить идеальную транс-ориентацию двух фосфиновых заместителей в ферроценильном фрагменте с торсионным углом Р-С-С-Р = 180.
Вместе с тем, увеличение объема заместителя у атома фосфора дизамещенных 1,Г-ферроцендиил-бис(фосфиновых кислот) приводит к существенному изменению типа водородной связи, обуславливая тем самым различия во взаимном расположении фосфиновых групп и кристаллической упаковке. Так, в случае 1,Г-ферроцендиил-бис(этилфосфиновой кислоты) (2с) реализуется сильная внутримолекулярная водородная связь между двумя кислотными фрагментами, что приводит к полностью заслоненной конформации и значительному отклонению циклопентадиенильных колец от параллельной ориентации на 5.5 (Рисунок 14). Рисунок 14. Кристаллическая упаковка 1,Г-ферроцендиил-бис(этилфосфиновой кислоты) (2с)
Реализация сильных внутримолекулярных водородных связей имеет место и в случае 1,Г-ферроцендиил-бис(фенилфосфиновой кислоты) (2d). Поскольку оба протона Р(0)ОН групп кислот 2с и 2d включены во внутримолекулярные взаимодействия, то в их кристаллах не наблюдается сильных межмолекулярных водородных связей, а только множество слабых С-Н...0 межмолекулярных взаимодействий, которые и определяют мотив упаковки в кристалле и молекулярную структуру кислот, в частности ориентацию заместителей R по отношению к ферроценильному фрагменту (Рисунок 15).
Кристаллическая упаковка 1,Г-ферроцендиил-бис(фенилфосфиновой кислоты) (2d) Более наглядно различная ориентация фрагмента R у атома фосфора фосфиновой группы может быть продемонстрирована с использованием диэдрального угла ф между PR группой и плоскостью циклопентадиенильного кольца. Направление группы R от атома железа ферроценового фрагмента соответствует нулевому значению (Рисунок 16). ф = 0 ф = 90 ф=180 Рисунок 16. Схематическое изображение ферроценилфосфиновых кислот в проекции Ньюмана (когда R и Fe по разные стороны относительно плоскости Ср кольца и максимально удалены ф = 0, когда R и Fe по одну сторону относительно плоскости Ср кольца и максимально приближены ф = 180).
Так, для ферроценил(Н-фосфиновой) кислоты (1а) значение ф составляет 135.2, в то время как для алкил- или арилзамещенных кислот (lb-d) находится в интервале 7-12.4. Следовательно, увеличение размера заместителя R у атома фосфора приводит к существенному затруднению вращения фосфинатной группы вокруг связи фосфор-углерод циклопентадиенильного кольца. Следует отметить, что атом водорода у атома фосфора не принимает участия в образовании водородных связей. Дополнительная информация о системе водородных связей ферроценилфосфиновых кислот (1, 2) была получена нами методом ИК спектроскопии, комбинированной с теорией функционала плотности (DFT)1. Колебания двух v(P=0) и двух 8РОН осцилляторов можно рассматривать как сложные колебания восьмичленной циклической системы (Р=О...Н-0-Р)2, которая обуславливает появление трех полос в рассматриваемой спектральной области: двух полос асимметричных и симметричных валентных колебаний Р=0-группы -1150 и 1200 см"1 соответственно и сильной полосы
Расчеты проведены к.ф-м.н., н.с. Герасимовой Т.П. и д.х.н., в.н.с. Капюбой С.А. (ИОФХ им.А.Е. Арбузова КазНЦ РАН) -1250 cm"1, соответствующей асимметричным деформационным колебаниям РОН. Полосы могут служить своего рода спектроскопическим «маркером» специфического внутримолекулярного типа водородных связей в молекулах дизамещенных 1,Г-ферроцендиил-бис(фосфиновых кислот) (2с) и (2d). Отсутствие этих полос в зарегистрированных ИК-спектрах кислот 2а и 2Ь, равно как и наличие полос vP=0 -1190 см"1, свидетельствует о межмолекулярном характере водородного связывания фрагментов Р(=0)ОН в данных соединениях.
Другой спектральный «маркер», удобный для аналитических целей - это сильная полоса пульсапионной моды незамещенного циклопентадиенильного кольца, наблюдаемая на частоте -1100 см"1 в спектрах монозамещенных кислот 1а и Id. Для Р-замещенного кольца Срр расчеты предсказывают пульсационную моду смешанной с деформациями РОН и валентными колебаниями Р=0 и смещенной в высокочастотную сторону к частоте -1200 см"1, так же, как и в случае диметилферроцена, где эта мода наблюдается на частоте 1229 см"1 [122, 123].
Таким образом, проведенное изучение строения серии ферроценилфосфиновых кислот (la-d) позволило нам впервые установить особенности их кристаллизации и, в частности, возможность образования энантиоморфных цепей, образованных посредством сильных межмолекулярных водородных связей. Вместе с тем, характер водородных связей в случае 1,Г-ферроцендиил-бис(К-фосфиновых кислот) (2a-d) существенным образом определяется природой заместителя R у атома фосфора -реализация межмолекулярных водородных связей имеет место в случае малых заместителей R=H (2а), Me (2b), в то время как для более объемных заместителей (R = Et (2с), Ph (2d)) у атома фосфора наблюдаются сильные внутримолекулярные водородные связи.
Одной из наиболее важных особенностей ферроцена и его производных является возможность легкого обратимого окисления/восстановления атома железа. Подобное явление было успешно использовано для конструирования сенсоров на различные вещества. В связи с этим, представлялось целесообразным изучить электрохимические свойства ферроценилфосфиновых кислот с целью выявления зависимости потенциала окисления/восстановления от природы заместителей у атома фосфора. Электрохимическое окисление моно- и дизамещенных ферроценилфосфиновых кислот было изучено в нейтральных, щелочных и кислотных средах в МеОН2 (Таблица
Кристаллическая структура и упаковка ферроценилфосфиновых кислот
Все работы, связанные с подготовкой исходных реагентов, проведением синтезов и выделением продуктов, были проведены в инертной атмосфере с использованием стандартной аппаратуры Шленка. Все растворители были очищены по известным методикам [150] и хранились в атмосфере инертного газа.
Синтез координационных полимеров и комплексов был осуществлен без применения специальных предосторожностей с использованием коммерчески достпных растворителей марки ЧДА и дистиллированной воды.
Спектры ЯМР были записаны на приборе Braker MSL-400 ( Н 400 МГц, 31Р 162.97539 МГц, 13С 100.6 МГц), Avance DRX 400 (Braker) ( 400 МГц, 31Р 162.97 МГц, 13С 100.6 МГц). Для записи спектров использовались 10 - 20% растворы в дейтерированных растворителях (СбОб, CDCb, ДМСО-сІб). В качестве внутреннего стандарта для спектров ЯМР Н и 13С использовался тетраметилсилан, а для спектров ЯМР 31Р как внешний стандарт 85% НзРСч.
Рентгенодифракционный монокристальный и порошковый анализ соединений выполнен в Отделении рентгеноструктурных исследований ЦКП САЦ на базе лаборатории дифракционных методов исследования (ДМИ) ИОФХ им. А.Е. Арбузова КазНЦ РАН с использованием автоматического дифрактометра Braker Smart Apex II CCD с молибденовым монохроматором МоКа (0.71073 А), а также в Институте неорганической химии Университета г. Лейпциг (Германия) на дифрактометре X-calibur-С (Oxford Diffraction). Управление экспериментом, сбор и обработка экспериментальных данных проведены с помощью программы АРЕХ2 [151]. Структуры расшифрованы прямым методом и уточнены методом наименьших квадратов с использованием пакетов программ SHELXTL [152], WinGX [153]. Координаты атомов водорода уточнены по соответствующим моделям «наездника», в ряде случаев положение атомов водорода аминной и гидроксильной групп определено из разностной карты разностной электронной плотности Фурье. Анализ структур и рисунки выполнены с использованием PLATON [154] и Mercury [155].
Рентгендифракционные порошковые эксперименты проведены на автоматическом рентгеновском дифрактометре Braker D8 Advance, оборудованном приставкой Vario и линейным координатным детектором Vantec. Использовано СиКа излучение, монохроматизированное (X(Cu-Kai) = 1.5406 А) германиевым изогнутым монохроматором Иохансона, режим работы рентгеновской трубки 40 kV, 40 mA. Эксперименты выполнены при комнатной температуре в геометрии Брэгг-Брентано с плоским образцом. Расчет дифрактограмм по монокристальным данным выполнен с помощью Mercury. Построение и анализ дифрактограмм выполнены с использованием программы Bruker Diffrac Eva [156].
Электрохимические свойства полученных координационных полимеров исследовали методами циклической вольтамперометрии (ЦВА) с использованием в качестве рабочего электрода стационарный дисковый электрод из стеклоуглерода, с площадью рабочей поверхности 3.14 мм2. Регистрацию ЦВА-кривых осуществляли на двухкоординатном самописце. Скорость линейной развертки потенциала составляла 50 мВ/с. Для измерения потенциалов использовался потенциостат ПИ-50-1 с программатором ПР-8 при включении термостатируемой (20С) электрохимической ячейки по трехэлектродной схеме. ЦВА-кривые снимали в ДМФА на фоне B114NBF4 (0.1 М). Электродом сравнения служила система Ag/0.01 М раствор AgNCb в MeCN (E(Fc/Fc+) = + 0.20 В). В качестве вспомогательного электрода использовали Pt-проволоку диаметром 1 мм. Концентрация субстрата составляет 5 х Ю"3 М.
Ряд исходных соединений был получен по известным методикам: (Et2N)2PCl [157, 158], PhP(0)(Cl)NEt2 [159], (EtO)P(Cl)NEt2 [160], (MeO)P(Cl)NEt2 [161], FcLi [162], fcLi2 [163].
Ферроцен, nBuLi, lBuLi, lBuOK, тетраметилэтилендиаммин, EtI и Mel являются коммерчески доступными реагентами и были использованы без предварительной очистки. 3.1. Синтез ферроценилфосфиновых кислот 3.1.1. Синтез ГЧ,1Ч-диэтиламида ферроценилфосфоновой кислоты (5а)
К суспензии ферроцениллития FcLi, полученной из ферроцена (21.1 г, 110 ммоль), lBuOK (2.36 г, 21 ммоль) и lBuLi (47 мл, 80 ммоль, 1.6 М в гексане) в 300 мл ТГФ, добавили по каплям раствор (Et2N)2PCl (16.8 г, 80 ммоль) в петролейном эфире (40 мл) при -78С. Реакционную смесь перемешивали в течение 6 часов при медленном нагревании до комнатной температуры. Органический раствор промыли от неорганических примесей дистиллированной водой (3 раза по 100 мл). Органический слой сушили над Na2S04, отфильтровали, очистили от избытка ферроцена колоночной хроматографией и упарили при пониженном давлении. Получено 17.8 г N,N-диэтиламида ферроценилфосфоновой кислоты (5а) в виде оранжевого масла с выходом 62%.
Аналогично, из ферроцена (21.1 г, ПО ммоль), lBuOK (2.36 г, 21 ммоль) и lBuLi (47 мл, 80 ммоль, 1.6 М в гексане) в 300 мл ТГФ и PhP(0)(Cl)(NEt2) (18.5 г, 80 ммоль). Получено 21.7 г N,N-диэтиламида ферроценил(фенил)фосфиновой кислоты (6а) в виде оранжевого масла с выходом 71%.
Получение солей аммония 1,Г-ферроцендиил-бис(фосфиновых кислот)
Расчет константы Кюри приводит к значению 9 = 1.3 К и константы Кюри-Вейса С = 2.44erg/G2/Monb. Эффективный магнитный момент составляет Seff=1.5 в пересчете на структурную единицу полимера, что соответствует иону кобальта (II) в высокоспиновом состоянии (Sco = 3/2) и свидетельствует об отсутствии обменных взаимодействий между ионами кобальта и железа ферроценильного фрагмента.
Схожие магнитные свойства демонстрирует и двумерный координационный полимер 17а на основе 1,Г-ферроцендиил-бис(Н-фосфиновой кислоты) (2а) и марганца (II). Температурная зависимость статической магнитной восприимчивости %(Т) и обратной восприимчивости %_1(Т) для соединения 17а, представленные на рисунке 48 могут быть хорошо описаны законом Кюри-Вейса % = С/(Т+в)+хо.
Температурная зависимость статической магнитной восприимчивости %т = М/Ни соответствующей обратной восприимчивости Хт1 согласно закону Кюри-Вейса для соединения 17а Вместе с тем, выдерживание данного соединения 17а при температуре 100С приводит к изменениям в структуре и составе. В высушенном образце 17а проявляется существенное изменение магнитных свойств, что выражается в уменьшении температуры Кюри с 8К до 6К и эффективного магнитного момента с 6.3 цв до б.іцв (Рисунок 49).
Интересно, что температурная зависимость магнитной восприимчивости %(Т) для синтезированного полимера 17а имеет тенденцию к насыщению ниже 3 К, что указывает на низкоразмерный характер магнитных обменных взаимодействий по одномерным или двумерным каналам. Это согласуется со структурой полимера, в котором ионы марганца отделены друг от друга посредством молекул воды, играющих роль диэлектрика. Отсутствие такого насыщения в высушенном образце координационного полимера 17а , свидетельствует о трехмерном характере обменных взаимодействий, что, по-видимому, связано с разрушением сети водородных связей в полимере (Рисунок 50).
Действительно, в обоих случаях измеренные М(Н) кривые магнетизации существенно отклоняются от зависимости Бриллюэна, описывающую поведение в магнитном поле невзаимодействующих ионов Мп(П) с S = 5/2. По сравнению с этим, намагниченность 17а показывает гораздо более слабую зависимость при малых полях, затем круто увеличиваясь над полем 2Т и достигая полного насыщения при 5Т, что свидетельствует о спин-флоп переходе, происходящего в сети малой размерности в случае преодоления магнитной зеемановской энергии над энергией антиферромагнитного связывания.
Зависимость магнетизации для высушенного образца 17а , напротив, не обладает подобной тенденцией, демонстрируя почти линейный рост намагниченности до значения приложенного поля ЗТ. При сильном поле М(Н) зависимость имеет тенденцию насыщения, хотя полное значение насыщения в 5Т еще не достигается даже при больших значениях приложенного поля, что для трехмерных антиферромагнитно коррелированных изотропных спиновых ансамблей соответствует непрерывному вращению спинов к направлению приложенного поля (Рисунок 51).
Для более полного понимания процессов, происходящих при выдерживании координационного полимера при температуре 100С, нами был использован метод термогравиметрии (Рисунок 52). Согласно полученным данным, нагревание соединения 17а в температурном диапазоне 65-155С приводит к потере всех четырех молекул воды (17% по массе) с образованием дегидратированной формы 17а , которая стабильна вплоть до 260С. Следует отметить, что, несмотря на наличие в молекуле полимера 17а двух типов молекул воды, координационной и сокристаллизованной, на графике кривая представлена только одним экстремумом в области 25-260, что свидетельствует об одновременном удалении всех четырех молекул воды, а не как ожидалось нами -двухступенчатом. 100
Данные порошкового рентгеноструктурного анализа соединения 17а (снизу - вверх): внизу (зел.) - дегидратированная форма 17а , черн. - рассчитанная кривая из данных монокристального анализа, рыж. - свежеполученная форма 17а, вверху (сер.) - регидратированная (восстановленная) форма из 17а 85
Значительный интерес представляют сорбционные свойства полученной дегидратированной формы полимера 17а . Так, сорбция азота при 77К составляет 8 см3/г, находящееся на уровне ошибки измерений. Отсутствие сорбции соединение 17а демонстрирует и при воздействии кислородсодержащих растворителей, таких как метанол, этанол, ДМФА, ТГФ или ацетон. Однако оригинальная структура полимера может быть восстановлена при помещении полимера 17а в воду или при воздействии паров воды даже при комнатной температуре, о чем свидетельствует полученные дифрактограммы (Рисунок 53). Поглощение в фазе насыщения хорошо соответствуют четырем молекулам воды на формульную единицу и 17% потери веса, наблюдаемого из термогравиметрической кривой. Таким образом, активированное соединение способно поглощать избирательно по сравнению с другими растворителями точно такой же объем воды, что первоначально присутствует в синтезированном соединении.
Кривая изотермы десорбции (Рисунок 54) не соответствует кривой адсорбции, образуя петлю гистерезиса. Очевидно, что сорбированные молекулы воды не могут быть легко десорбированы даже при низком относительном давлении. Чтобы удалить воду необходимо повторно нагреть образец. Более того, это процесс адсорбции/удаления воды нагреванием может быть многократно повторен без существенной потери активности.