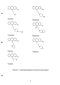Содержание к диссертации
Введение
1. Обзор литературы 7
1.1. Физико-химические свойства производных фенотиазина 7
1.2: Определение производных фенотиазина в биообъектах 9
1.2.1. Общие проблемы пробоподготовки, 9
1.2.2. Методы определения фенотиазинов 13
1.2.2.1. Идентификация по качественным реакциям 14
1.2.2.2. Спектральные методы 15
1.2.2.3. Метод тонкослойной хроматографии 19
1.2.2.4. Метод высокоэффективной жидкостной хроматографии 31
1.2.2.5. Метод газовой хроматографии 34
1.2.2.6: Электрофорез. 35
1.3; Скрининг 37
1.4. Анализ метаболитов 42
1.5. Выводы к литературному обзору и постановка задач исследования 43
2. Экспериментальная часть и обсуждение результатов 45
2.1. Использованное оборудование и материалы 45
2.2. Теоретическое и экспериментальное обоснование аналитической схемы определения производных фенотиазина методом тонкослойной хроматографии 47
2.2.1. Твердофазная экстракция 48
2.2.2. Тонкослойная хроматография 59
2.2.2.1. Экспериментальный поиск оптимального элюента 59
2.2.2.2. Описание хроматографического процесса. 75
2.2.2.4. Количественное определение исследуемых веществ на основе метода тонкослойной хроматографии 93
2.2.3. Определение фенотиазинов методом ВЭЖХ 98
2.2.3.1. Оптимизация условий хроматографирования фенотиазинов 99
2.2.3.2. Количественное определение методом ВЭЖХ 113
2.2.4. Построение аналитической схемы определения фенотиазинов..117
Выводы; 122
Список использованных источников 124
- Определение производных фенотиазина в биообъектах
- Выводы к литературному обзору и постановка задач исследования
- Теоретическое и экспериментальное обоснование аналитической схемы определения производных фенотиазина методом тонкослойной хроматографии
- Количественное определение исследуемых веществ на основе метода тонкослойной хроматографии
Введение к работе
При лечении психических и неврологических заболеваний широко используются препараты, обладающие нейролептическим действием, рекомендованные и утвержденные перечнем Минздрава России. Заметное место в нем занимают производные фенотиазина. Выбор назначаемых препаратов из числа рекомендуемых и их дозы зависят от состояния больного и выраженности того или иного синдрома. Поэтому в терапевтической практике, а также при диагностике отравлений несомненный практический интерес представляет разработка унифицированной методики контроля такого рода препаратов.
В судебной и клинической токсикологии для рутинного скрининга наркотических, лекарственных веществ и их метаболитов в биологических средах широко используются различные виды хроматографии [1-9]. Особую популярность в настоящее время приобретает систематический токсикологический анализ, так как такой подход позволяет с высокой степенью надежности определять широкий спектр токсикантов в биообразцах.
Обычная стратегия аналитической процедуры токсикологического анализа включает на первом этапе скрининговые тесты, на втором этапе подтверждающий анализ проб, дающих положительные реакции при скрининге, вторым независимым методом с количественным определением идентифицируемого вещества. Такая двухступенчатая процедура оптимальна для анализов, в которых идентифицируются вещества, входящие в определенный ограниченный перечень. Однако в судебной и особенно в клинической токсикологии не всегда возможно ограничиться заранее определенным списком веществ, и для скрининга необходимо использовать метод, охватывающий как можно более широкий круг потенциальных токсикантов определенного класса. Существующие методики направлены главным образом на групповую идентификацию и контроль отдельных наиболее часто используемых веществ и обладают различными недостатками по селективности и чувствительности. В этой связи практический интерес представляет разработка унифицированной методики скрининга соединений класса фенотиазина для терапевтической практики, а также при диагностике отравлений.
Целью настоящей работы являлась разработка унифицированной аналитической схемы хроматографического определения производных фенотиазина в биологических средах для терапевтической практики и токсикологии. В соответствии с этим в работе решались следующие задачи: - обоснование и построение оригинальной схемы скрининга биологических объектов для идентификации производных фенотиазина методом тонкослойной хроматографии; поиск и исследование методов концентрирования и разделения для извлечения производных фенотиазина из биологических жидкостей; оптимизация условийТСХ-скрипинга фенотиазинов; разработка методики количественного определения производных фенотиазина методом ВЭЖХ.
Диссертационная работа выполнена при поддержке Российского фонда фундаментальных исследований (РФФИ-юг грант №03-03-96542)
Определение производных фенотиазина в биообъектах
В большинстве случаев. пробоподготовка при анализе биообъектов является основным, определяющим этапом аналитического метода, так как требует больших затрат труда, времени и химических реактивов. Среди классических и вместе с тем наиболее трудоемких процедур приготовления пробы следует отметить прежде всего жидкостную экстракцию, жидкость-жидкостную переэкстракцию и отгонку растворителя на ротационном испарителе. Жидкостная экстракция неизбежна, если матрица образца твердая; в этом случае объектом дальнейших манипуляций является первоначальный жидкий экстракт [10]; аналогом жидкостной экстракции для извлечения аналитов из твердых образцов может служить сверхкритическая флюидная экстракция [11]. Во всех остальных случаях, то есть при работе с жидкими образцами, классические методы пробоподготовки можно заменить значительно менее ресурсоемким и более удобным методом твердофазной экстракции (ТФЭ) в сочетании с методом твердофазной очистки. Большинство анализируемых биообъектов делятся на четыре группы: 1) жидкости с небольшим содержанием биологического материала (моча); 2) жидкости с заметным содержанием биологического материала (кровь); 3) твердые вещества, которые являются простыми соединениями или простыми смесями (таблетки, капсулы, порошок); 4) твердые вещества, которые являются сложными смесями (волосы, ногти). Каждая из этих групп требует своей аналитической схемы пробоподготовки. В дальнейшем нами рассматривались только первые две группы биообъектов. Наиболее распространенным и простым объектом исследования на лекарственные соединения является моча, вследствие низкого содержания белковых компонентов.
Ее предаиалитическая обработка состоит из различных операций: прямого концентрирования, экстракции растворителем, хроматографического разделения или сорбции на твердом сорбенте. Как правило, изолирование из мочи проводят по схеме, приведенной на рисунке 3 [12]. Другим объектом анализа на наличие лекарственных веществ и их метаболитов является кровь. Обработке экстракцией может быть подвергнута цельная кровь плазма или сыворотка. . Предаиалитическая подготовка крови проводится по схеме, приведенной на рисунке 4 [12]. В работе [131 предложена схема пробоподготовки для извлечения кислых и основных соединений из крови. Для извлечения оснований кровь подщелачивают аммиаком и экстрагируют толуолом. Для разделения основных и слабоосновных веществ на стадии пробоподготовки к толуолу сначала добавляют 0,1 М раствор серной кислоты, перемешивают и разделяют органическую и водную части, затем к толуолу добавляют 6 М соляную кислоту и снова перемешивают. В итоге получают две водные фракции основных и слабоосновных соединений. Для экстракции фенотиазинов из плазмы крови авторами [14] использованы гексан и диэтиловый эфир. При этом экстракцию плазмы проводили подщелачиваемой гидроксидом натрия. Проблема разделения и идентификации производных фенотиазина стоит очень давно. Начиная с 60-х г. прошлого века в литературе периодически встречаются публикации, посвященные этой теме.
Результаты комплексного исследования по применению физико-химических методов к анализу производных фенотиазина, а также их изолированию обобщены в трудах [15, 16]. Возможности применения используемых методов определения для исследования соединений данного класса приведены в обзорах и монографиях [17-22]. Аналитические исследования этой группы лекарственных препаратов отражены в работе [23]. В обзоре [24] приведены сведения по качественному и количественному определению производных фенотиазина, опубликованные в 1978-1984 гг. Для определения производных фенотиазина использовали самые различные мегоды, начиная от качественных реакций и заканчивая использованием современных приборов. В литературном обзоре собраны методы идентификации по качественным реакциям, спектральные, хроматографические, электрофоретические методы определения, а также методы скрининга биологических объектов.
В работе [25] разработан систематический ход анализа при идентификации хлорацизина, фторацизина, трифтазина, метеразина, аминазина и этаперазина по качественным реакциям. Схема идентификации препаратов фенотиазинового ряда основана на способности фенотиазинового кольца легко окисляться, образуя окрашенные продукты окисления. Степень окисления, а следовательно, и окраска зависят от заместителей во 2-м и 10-м положениях фенотиазинового кольца, от наличия других функциональных групп и различны для ряда препаратов. Таким образом, система качественных реакций позволяет идентифицировать неизвестный препарат из числа представителей фенотиазинов. Определение проводили с 1-2 мг чистых препаратов. В работе [26] расширен подход, описанный в работе [25]. Добавлены новые вещества, такие как пропазин, дипразин, фторфеназин и этмозин. Изучены новые условия проведения реакций, обеспечивающие более четкое разделение
Выводы к литературному обзору и постановка задач исследования
Представленный обзор литературы показывает, что определению фенотиазинов уделяется достаточное внимание, методы обеспечивают приемлемую чувствительность и точность определения, однако решение проблемы их системного определения в биообъектах, развитие и теоретическое обоснование « методических подходов к построению аналитических схем представляет значительный теоретический и практический интерес. В соответствии с этим, предметом отдельного рассмотрения и целью исследования являются: совершенствование и разработка методов пробоподготовки на основе твердофазной экстракции, обеспечивающей одновременную очистку и концентрирование целевых компонентов биообъектов. оптимизация методологии скрининга с целью повышения надежности его результатов, экспрессное и упрощению процедуры и обработки данных. разработка эффективных, чувствительных и экспрессных методов аналитического контроля производных фенотиазина в биообъектах. разработка комплексной аналитической схемы одновременного определения веществ фенотиазинового ряда в биопробах, включающей селективную пробоподготовку, оперативный скрининг, подтверждение его результатов, надежное определение компонентов инструментальными методами анализа и соответствующую решаемой задаче математическую обработку аналитической информации.
Список использованных реактивов, растворителей и материалов приведен ниже. - н-гсксан, ТУ 6-09-3375-78 -бензол, ГОСТ 5955-75 - ацетонитрил, ТУ 6-09-3534-74 - эфир диэтиловый, ГОСТ 6265-74 - ацетон, ГОСТ 2603-79 -этилацетат, ГОСТ 22300-76 - хлороформ, ГОСТ 20015-74 - спирт метиловый, ГОСТ 6995-77 - спирт этиловый ректификат, ГОСТ 5962-67 - спирт изо-пропиловый ГОСТ 9805-84 -натрия фосфатоднозамещенный ч.д.а. - кислота серная х.ч., ГОСТ 4204-77 - формалин фарм., ГОСТ 1625-89 - железа хлорид (III) ч.д.а. - калия перманганат, ГОСТ 20490-75 - аммиак водный ГОСТ 3760-79 - 1 М раствор трифторуксусной кислоты пластинки «Сорбфил» силикагель СТХ-1А, зернение 5-17 и 8-12 мкм, размер 10x10 см, подложка ПЭТФ или AI - камера для ТСХ - нагревающее устройство УСП-1 - колонка Зорбакс ODS, 80 мм 5 мкм, Медикант - колонка Нуклеосил-С]8, 80 мм 5 мкм, Медикант - колонка Диасорб-ІЗОСібТ, 80 мм 6 мкм, Медикант - сорбент полистирол-дивинилбензол (ПС-ДВБ) - хроматограф «Милихром-4» с УФ-детектором - весы аналитические WA-34, погрешность взвешивания ± 0,00005 г - микрошприц Hamilton 1-50 мкл - пипетка, 10 мл, ГОСТ 20292-74 Исследовали следующие вещества: аминазин (1), перициазин (2), этаперазин (3), нонахлазин (4), сонапакс (5), трифтазин (6) и тизерцин (7). Растворы исследуемых веществ готовили из лекарственных форм — таблетки или ампулы. Для извлечения веществ несколько таблеток с общим количеством 5-10 мг производного фенотиазина растирали в ступке, перемещали порошок в пробирку и заливали 1 мл ацетонитрила. Выдерживали при периодическом перемешивании в течение 1 часа и декантировали. Из полученных растворов готовили рабочие растворы для ТСХ с концентрацией 1-5 мг/мл и для ВЭЖХ..- 50 мкг/мл. Для приготовления рабочих растворов из ампул их содержимое разбавляли ацетонитрилом. Определение органических компонентов в биологических объектах со сложной матрицей при их малых содержаниях накладывает некоторые ограничения на все стадии анализа и вызывает ряд проблем: - мешающее влияние компонентов пробы; - чувствительность методов; - селективность извлечения целевых компонентов; - длительность и трудоемкость анализа. В значительной степени надежность аналитических определений органических веществ в биообъектах может быть повышена при использовании хроматографических методов, обеспечивающих одновременное разделение и детектирование компонентов, а при наличии подходящего метода концентрирования и значительное снижение пределов обнаружения. Упростить процедуру анализа в отдельных случаях можно с помощью предварительного ТСХ-скрининга, который при отрицательном результате избавляет от необходимости последующего инструментального определения. Разработка и практическая реализация подобной аналитической схемы требует специального теоретического и экспериментального обоснования.
Благодаря неоспоримым преимуществам перед жидкость-жидкостной экстракцией, метод твердофазной экстракции уже более двух десятков лет является объектом интенсивных исследований в области адсорбционных технологий [80]. Последние успехи в применении ТФЭ связаны, прежде всего с появлением на рынке коммерчески доступных полимерных адсорбционных материалов нового типа, сочетающих высокую емкость, механическую прочность и химическую стабильность. Применение новых типов адсорбционных материалов привело к прорыву в области твердофазной экстракции, и, как следствие, к модернизации методов ТФЭ. В иностранной печати последние достижения в области твердофазной экстракции отражены в ряде обзоров [80-88]. До сравнительно недавнего времени алкилированные С8 и С18 силикагели являлись фактически единственными адсорбционными материалами для твердофазной экстракции. В очень редких случаях в этих целях применялись полистирол-дивинилбензольные ПС-ДВБ (PS-DVB) смолы XAD-1-4 [80], В настоящее время ситуация в корне изменилась: на лидирующее место выходят полимерные адсорбционные материалы для ТФЭ, за ними по частоте применения следуют активированные угли и лишь затем - С8, С18 и другие привитые силикагели [84]. Причина отказа от привитых силикагелей как адсорбентов для ТФЭ состоит в том, что угли и смолы, особенно с большой удельной поверхностью, обладают на один-два порядка большими, чем С18, объемами пробоя при твердофазной экстракции из водных и водио-органических систем.
Теоретическое и экспериментальное обоснование аналитической схемы определения производных фенотиазина методом тонкослойной хроматографии
Исследовали следующие вещества: аминазин (1), перициазин (2), этаперазин (3), нонахлазин (4), сонапакс (5), трифтазин (6) и тизерцин (7). Растворы исследуемых веществ готовили из лекарственных форм — таблетки или ампулы. Для извлечения веществ несколько таблеток с общим количеством 5-10 мг производного фенотиазина растирали в ступке, перемещали порошок в пробирку и заливали 1 мл ацетонитрила. Выдерживали при периодическом перемешивании в течение 1 часа и декантировали. Из полученных растворов готовили рабочие растворы для ТСХ с концентрацией 1-5 мг/мл и для ВЭЖХ..- 50 мкг/мл. Для приготовления рабочих растворов из ампул их содержимое разбавляли ацетонитрилом. Определение органических компонентов в биологических объектах со сложной матрицей при их малых содержаниях накладывает некоторые ограничения на все стадии анализа и вызывает ряд проблем: - мешающее влияние компонентов пробы; - чувствительность методов; - селективность извлечения целевых компонентов; - длительность и трудоемкость анализа. В значительной степени надежность аналитических определений органических веществ в биообъектах может быть повышена при использовании хроматографических методов, обеспечивающих одновременное разделение и детектирование компонентов, а при наличии подходящего метода концентрирования и значительное снижение пределов обнаружения. Упростить процедуру анализа в отдельных случаях можно с помощью предварительного ТСХ-скрининга, который при отрицательном результате избавляет от необходимости последующего инструментального определения. Разработка и практическая реализация подобной аналитической схемы требует специального теоретического и экспериментального обоснования.
Благодаря неоспоримым преимуществам перед жидкость-жидкостной экстракцией, метод твердофазной экстракции уже более двух десятков лет является объектом интенсивных исследований в области адсорбционных технологий [80]. Последние успехи в применении ТФЭ связаны, прежде всего с появлением на рынке коммерчески доступных полимерных адсорбционных материалов нового типа, сочетающих высокую емкость, механическую прочность и химическую стабильность. Применение новых типов адсорбционных материалов привело к прорыву в области твердофазной экстракции, и, как следствие, к модернизации методов ТФЭ. В иностранной печати последние достижения в области твердофазной экстракции отражены в ряде обзоров [80-88]. До сравнительно недавнего времени алкилированные С8 и С18 силикагели являлись фактически единственными адсорбционными материалами для твердофазной экстракции. В очень редких случаях в этих целях применялись полистирол-дивинилбензольные ПС-ДВБ (PS-DVB) смолы XAD-1-4 [80], В настоящее время ситуация в корне изменилась: на лидирующее место выходят полимерные адсорбционные материалы для ТФЭ, за ними по частоте применения следуют активированные угли и лишь затем - С8, С18 и другие привитые силикагели [84]. Причина отказа от привитых силикагелей как адсорбентов для ТФЭ состоит в том, что угли и смолы, особенно с большой удельной поверхностью, обладают на один-два порядка большими, чем С18, объемами пробоя при твердофазной экстракции из водных и водио-органических систем. Одними из основных характеристик твердофазных адсорбционных материалов по отношению концентрируемым аналитам являются селективность и универсальность. Следует отметить, что такая классификация адсорбционных материалов для ТФЭ является во многом условной, так как многие из них могут сочетать количественную адсорбцию определенной группы аналитов (внутригрупповую универсальность) с отсутствием адсорбции нежелательных соединений (межгрупповой селективностью). На практике такие частично селективные адсорбенты применяются весьма часто, так как позволяют провести концентрирование и очистку пробы «в один шаг». К примеру, для скрининга (группового определения) низкомолекулярных веществ из биологических жидкостей или растительных образцов подготовка пробы должна включать твердофазную экстракцию на адсорбенте, обладающим максимальным сродством к любым низкомолекулярным аналитам (внутригрупповая универсальность) и минимальное - ко всем высокомолекулярным соединениям (межгрупповая селективность). Основными характеристиками полимерных материалов для ТФЭ являются степень сшивки, удельная площадь поверхности, гидрофобность и распределение пор по размеру. Адсорбционные свойства материалов зависят от совокупности этих характеристик; по этой же причине часто бывает затруднительно сравнивать эффективность адсорбентов различных фирм, тем более что ряд характеристик могут оставаться неизвестными.
Степень сшивки оказывает влияние на механическую прочность материала и на его набухаемость в различных растворителях. «Идеальный» адсорбционный материал должен обладать высокой механической прочностью и одинаковой набухаемостью в полярных и неполярных растворителях. Наиболее полно этим требованиям удовлетворяют полимерные адсорбенты высокой степени сшивки. Как правило, такие адсорбенты обладают большой, более 1000 м/г, удельной поверхностью. В иностранной печати адсорбционные материалы такого типа называются «материалами с высокой степенью сшивки», отечественными сотрудниками для обозначения такого типа, полимерных адсорбционных материалов было предложено название «сверхешитые» (hypercrosslinked) [89]. В настоящее время для ТФЭ применяются более десятка марок коммерчески доступных сверхсшитых материалов, среди которых можно отметить LiChrolut EN (ПС-ДВБ, 1200 м2/г), Isolute ENV (ПС-ДВБ), Oasis HLB. (ПС-ДВБ-винилпирролидон). Сверхешитые полимерные материалы совместимы с любыми растворителями: водой, спиртами, эфирами, хлорорганикой и углеводородами. Термин «совместимость» в данном случае означает, что, с одной стороны, сверхешитый адсорбционный материал набухает в любом растворителе; с другой стороны, жесткость полимерной сетки не позволяет ему набухать больше определенного предела; при пропускании через картридж растворителей различной природы каждый последующий быстро и количественно вытесняет предыдущий. Особенным свойством сверхсшитых полистиролов является их способность концентрировать аналиты не только из водных сред, по и из неполярных растворителей [90, 91]. Режим сорбции в этих условиях был назван «квази-нормально-фазовым» для сверхсшитых полистирольньгх адсорбентов, не содержащих полярных групп [92]. Все эти характеристики определяют универсальность и перспективность полистиролов для концентрирования широкого спектра веществ с различными свойствами. Поэтому для подготовки пробы к анализу мы использовали метод твердофазной экстракции с применением в качестве сорбента сверхсшитого полистирола. Предварительно исследовали сорбируемость фенотиазинов на сверхсшитом полистироле на модельных растворов. Патрон объемом 1 см3 наполняли сорбентом, масса которого составляла 230 мг. Сорбент активировали прокачиванием через патрон 10 мл дистиллированной воды и промывали последовательно ацетоном и этанолом для удаления посторонних веществ. Степень очистки сорбента контролировали по разнице в оптической плотности этанола до и после прокачивания через патрон при длине волны 254 нм. Важной характеристикой сорбента является его динамическая емкость, она определяет максимально возможную массу вещества, которая может на нем сорбироваться. Необходимое условие возможности применения того или иного сорбента в аналитической практике - его достаточная динамическая емкость. Динамическую емкость сверхсшитого полистирола изучали на водных растворах аминазина с концентрацией 1 мг/мл при скорости прокачивания его через патрон 1 мл/мин. Процесс сорбции контролировали спектрофотометрически при длине волны 254 нм. Зависимость оптической плотности от объема прокачанного раствора показана на рисунке 6.
Количественное определение исследуемых веществ на основе метода тонкослойной хроматографии
Благодаря неоспоримым преимуществам перед жидкость-жидкостной экстракцией, метод твердофазной экстракции уже более двух десятков лет является объектом интенсивных исследований в области адсорбционных технологий [80]. Последние успехи в применении ТФЭ связаны, прежде всего с появлением на рынке коммерчески доступных полимерных адсорбционных материалов нового типа, сочетающих высокую емкость, механическую прочность и химическую стабильность. Применение новых типов адсорбционных материалов привело к прорыву в области твердофазной экстракции, и, как следствие, к модернизации методов ТФЭ. В иностранной печати последние достижения в области твердофазной экстракции отражены в ряде обзоров [80-88]. До сравнительно недавнего времени алкилированные С8 и С18 силикагели являлись фактически единственными адсорбционными материалами для твердофазной экстракции. В очень редких случаях в этих целях применялись полистирол-дивинилбензольные ПС-ДВБ (PS-DVB) смолы XAD-1-4 [80], В настоящее время ситуация в корне изменилась: на лидирующее место выходят полимерные адсорбционные материалы для ТФЭ, за ними по частоте применения следуют активированные угли и лишь затем - С8, С18 и другие привитые силикагели [84]. Причина отказа от привитых силикагелей как адсорбентов для ТФЭ состоит в том, что угли и смолы, особенно с большой удельной поверхностью, обладают на один-два порядка большими, чем С18, объемами пробоя при твердофазной экстракции из водных и водио-органических систем. Одними из основных характеристик твердофазных адсорбционных материалов по отношению концентрируемым аналитам являются селективность и универсальность. Следует отметить, что такая классификация адсорбционных материалов для ТФЭ является во многом условной, так как многие из них могут сочетать количественную адсорбцию определенной группы аналитов (внутригрупповую универсальность) с отсутствием адсорбции нежелательных соединений (межгрупповой селективностью). На практике такие частично селективные адсорбенты применяются весьма часто, так как позволяют провести концентрирование и очистку пробы «в один шаг». К примеру, для скрининга (группового определения) низкомолекулярных веществ из биологических жидкостей или растительных образцов подготовка пробы должна включать твердофазную экстракцию на адсорбенте, обладающим максимальным сродством к любым низкомолекулярным аналитам (внутригрупповая универсальность) и минимальное - ко всем высокомолекулярным соединениям (межгрупповая селективность). Основными характеристиками полимерных материалов для ТФЭ являются степень сшивки, удельная площадь поверхности, гидрофобность и распределение пор по размеру. Адсорбционные свойства материалов зависят от совокупности этих характеристик; по этой же причине часто бывает затруднительно сравнивать эффективность адсорбентов различных фирм, тем более что ряд характеристик могут оставаться неизвестными.
Степень сшивки оказывает влияние на механическую прочность материала и на его набухаемость в различных растворителях. «Идеальный» адсорбционный материал должен обладать высокой механической прочностью и одинаковой набухаемостью в полярных и неполярных растворителях. Наиболее полно этим требованиям удовлетворяют полимерные адсорбенты высокой степени сшивки. Как правило, такие адсорбенты обладают большой, более 1000 м/г, удельной поверхностью. В иностранной печати адсорбционные материалы такого типа называются «материалами с высокой степенью сшивки», отечественными сотрудниками для обозначения такого типа, полимерных адсорбционных материалов было предложено название «сверхешитые» (hypercrosslinked) [89]. В настоящее время для ТФЭ применяются более десятка марок коммерчески доступных сверхсшитых материалов, среди которых можно отметить LiChrolut EN (ПС-ДВБ, 1200 м2/г), Isolute ENV (ПС-ДВБ), Oasis HLB. (ПС-ДВБ-винилпирролидон). Сверхешитые полимерные материалы совместимы с любыми растворителями: водой, спиртами, эфирами, хлорорганикой и углеводородами. Термин «совместимость» в данном случае означает, что, с одной стороны, сверхешитый адсорбционный материал набухает в любом растворителе; с другой стороны, жесткость полимерной сетки не позволяет ему набухать больше определенного предела; при пропускании через картридж растворителей различной природы каждый последующий быстро и количественно вытесняет предыдущий. Особенным свойством сверхсшитых полистиролов является их способность концентрировать аналиты не только из водных сред, по и из неполярных растворителей [90, 91]. Режим сорбции в этих условиях был назван «квази-нормально-фазовым» для сверхсшитых полистирольньгх адсорбентов, не содержащих полярных групп [92]. Все эти характеристики определяют универсальность и перспективность полистиролов для концентрирования широкого спектра веществ с различными свойствами. Поэтому для подготовки пробы к анализу мы использовали метод твердофазной экстракции с применением в качестве сорбента сверхсшитого полистирола. Предварительно исследовали сорбируемость фенотиазинов на сверхсшитом полистироле на модельных растворов. Патрон объемом 1 см3 наполняли сорбентом, масса которого составляла 230 мг. Сорбент активировали прокачиванием через патрон 10 мл дистиллированной воды и промывали последовательно ацетоном и этанолом для удаления посторонних веществ. Степень очистки сорбента контролировали по разнице в оптической плотности этанола до и после прокачивания через патрон при длине волны 254 нм. Важной характеристикой сорбента является его динамическая емкость, она определяет максимально возможную массу вещества, которая может на нем сорбироваться. Необходимое условие возможности применения того или иного сорбента в аналитической практике - его достаточная динамическая емкость. Динамическую емкость сверхсшитого полистирола изучали на водных растворах аминазина с концентрацией 1 мг/мл при скорости прокачивания его через патрон 1 мл/мин. Процесс сорбции контролировали спектрофотометрически при длине волны 254 нм. Зависимость оптической плотности от объема прокачанного раствора показана на рисунке 6.